

망막색소변성은 인간의 만성 맹인성 질환으로 임상 유병률이 4000분의 1로 치료 효과와 예후(prognosis)가 좋지 않아 결국 실명하게 되고 환자와 가족에게 심각한 심리적 스트레스를 줄 수 있다. 하지만 전 세계 안과의사와 연구진은 망막색소변성에 주목해 치료법을 연구하고 있다. "많은 사람들이 당신과 함께 질병과 싸우고 있지만 당신은 외롭지 않아요."
병리 연구
망막색소변성(Retinitis Pigmentosa, RP)의 병리학적 특징은 주로 광수용기 세포의 성변성이다. 광수용기 세포는 간상 세포(Rod bipolar cell)과 원뿔 쌍극 세포(Cone bipolar cell)을 포함하고 있으며, RP에서 먼저 간상 세포(Rod bipolar cell)가 누진 변성을 받게 되고, 이어서 생물 공급 장애 및 산화 스트레스 등의 반응에 의해 2차성 원뿔 쌍극 세포(Cone bipolar cell) 변성이 나타나 최종 조직학적으로 간상 세포와 원뿔 쌍극 세포의 손실 감소가 나타난다 (그림 1).
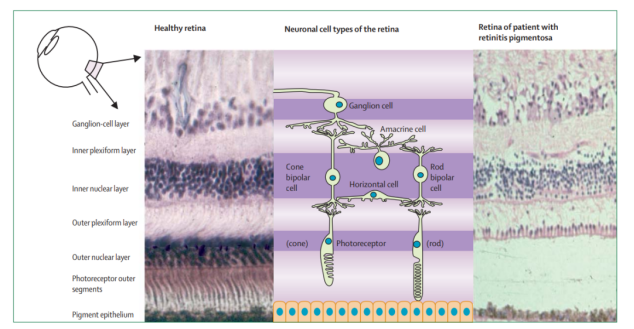
그림 1. 건강한 망막(왼쪽)과 중기의 RP환자 망막; (오른쪽) 조직학적 외관
RP의 최초 증상은 야간 시력저하 후 점차 시야를 상실하여 관상 시야(Tubular vision)가 보이는 경우(그림2)

그림 2. 관상시야 (시야 중 가시범위는 병의 진행에 따라 점차 감소)
결국 시력은 실명에 가깝거나 완전 실명에 가까워지고 있다(그림 3).
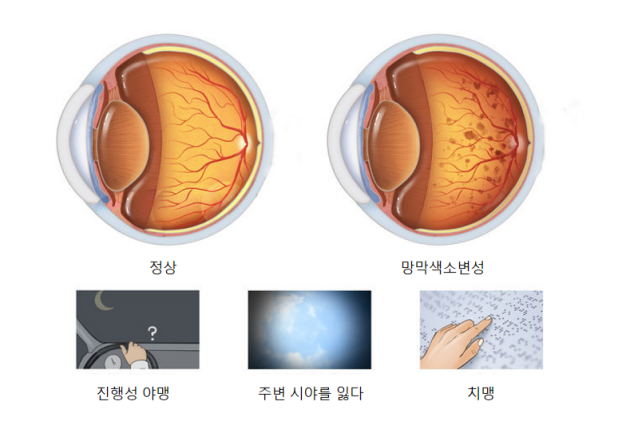
그림3. RP 임상증상 환자 병의 상황 경과에 따른 변화
안저 발현은 보통 골세포양색소침착(hyperpigmentation), 망막혈관협착과 시신경 원판(optic disc) 왁스상백색의 3중증상(그림4).
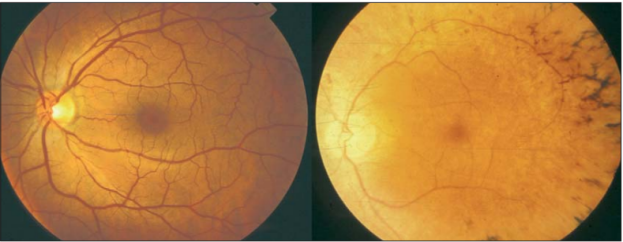
그림 4. 건강한 개체(왼쪽)와 RP환자(오른쪽)의 안저영상
RP 환자의 이미징 그림은 시신경 원판이 창백하고 망막 혈관이 좁아지며 골세포 모양의 외주 망막 색소 침착을 뚜렷하게 볼 수 있다
RP는 주로 야맹증, 점진적 시야결손, 시력저하, 눈 밑 퇴행성 변화, 색맹 등의 증상이 나타나며 일부 환자는 백내장, 녹내장 등의 증상을 보인다.
병원성 유전자
1990년 망막 색소변성을 일으키는 첫 유전자가 발견됐다. 현재 최소 79개 유전자의 돌연변이가 이 질병을 일으키는 것으로 보고되고 있다(표 1).
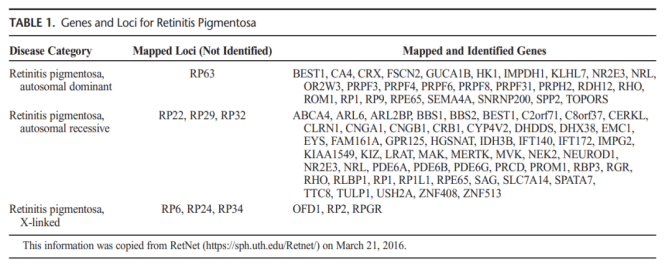
표 1 RP의 원인이 되는 돌연변이 유전자[4]
군체마다 단일 유전자의 돌연변이 비율이 약간 다를 수 있고 그러나 RP를 일으키는 주요 유전자는 비슷한다. 중국의 RP 사례 (유전자 돌연변이 유발) 에서 2/3 의 사례는 CYP4V2, RHO, USH2A, RPGR, CRB1, RP2, CHM 등 7 개의 유전자 돌연변이로 인한 것이다.
알려진 유전정보에 의해 구축된 유전자 변형 또는 녹아웃 동물모델은 RP연구의 가치 있는 도구가 된다. 돌연변이의 병원성 작용을 확인할 수 있을 뿐만 아니라 질병의 병리 생리학도 천명할 수 있다. 그러나 같은 돌연변이로 인해 생쥐와 사람 사이에 다른 표형이 존재할 수 있다는 점에 유의해야 한다.
동물 모델
기존에 알려진 RP동물모델은 자연적으로 돌연변이가 일어나는 동물모델과 유전자변형 기술을 인공적으로 적용해 구축한 동물모델 두 가지로, 이하 일부 동물모델을 선택하여 소개한다.
자연적으로 돌연변이가 일어나는 동물 모델
NO.1 rd mouse
rd 마우스는 상염색체 열성 유전 RP 동물모델이다. 원발성 RP 상염색체 열성 유전자 환자와 같은 유전자 변이와 비슷한 유전자 표형을 가지고 있기 때문에, 따라서 이 모델은 다른 망막변성 동물 모델보다 우수하여 망막변성 발병 기전을 연구하는 데 비교적 이상적인 연구 대상이 되었다. rd 마우스는 Pde6b 유전자의 부족로 인해 발생하며 Pde6b 유전자에 의해 무의미한 돌연변이가 발생하여 세포 내 Phosphodiesterase β subunit의 기능 장애를 초래한다. 순합성 Pde6b 유전자를 가진 생쥐는 출생 초기부터 망막변성이 심하도록 했다.
NO.2 RCS Rat
RCS Rat는 상염색체 열성 유전 RP 동물모델로 RP 병인과 치료법 연구에 먼저 응용된 비교적 성숙한 망막 퇴화 동물모델로 다양한 유형의 망막변성을 연구하는 고전 동물모델로 인간 RP와 많은 유사점이 있다. RCS Rat는 생후 2주부터 눈을 뜨기 시작한다. 망막 광수용체 세포는 생후 17일 후에 발육이 완료된다. 생후 25일 후에 이미 광수용체 변성체 징후가 보이다. 출생 후 35d, 대량의 광수용기 세포가 시들어 죽다. 생후 8 주 후, 후극부( posterior pole) 망막 색소 상피 세포가 없어지기 시작했다. 출생 후 60d, 약 99%의 광수용체 세포에 변성이 발생한다. 출생 후 70d, 망막 색소 상피 부족 영역에서 모세혈관 내피창이 없어지고 세포가 두꺼워진다. 이러한 다중심에서 발생하는 퇴행성 변화는 망막의 다른 부위에 나타날 수 있다. 생후 3개월쯤 되면 광수용체 세포가 모두 사라진다. 퇴행성 변광수용체 세포 가장자리가 발생하는 어떤 색소 상피세포는 같은 연령의 정상적인 동종 세포보다 많고 세포질 내에 미토콘드리아가 많아져 세포 기저면의 주름도 현저히 많아진다.
NO.3 rds mouse
rds 마우스는 상염색체 우성 유전 RP 동물모델로 RP를 연구하는 고전 동물모델이다.이 마우스는 peripherin/rds유전자의 엑손에 9.2kb의 게놈 반복소자가 삽입돼 정상적인 단백질이 만들어지지 않았다. Peripherin/rds 유전자 발현 산물은 척추동물의 광수용기Outer disc membrane의 구조 단백질로, 이 단백질은 막판의 안정성과 정상적인 형태를 유지하는 데 중요한 기능을 한다.
Peripherin/rds 유전자에 순합 돌연변이가 발생하여 정상적인 disc membrane protein 생성에 장애가 발생하게 되어 광수용체 outer disc membrane의 정상적인 형성에도 장애가 발생하게 된다. 인간에서는 RP를 비롯해 유전성 황반변성 등 다양한 망막병변을 일으킬 수 있다. 광수용체(Photoreceptor) 세포 외절(Extracellular ganglion)은 순합성 마우스에서 발육하지 않고 외총상층(outer plexiform layer)과 외핵층(outer nuclear layer)은 생후 2주부터 점차 얇아지고 망막감광세포는 생후 12개월쯤 지나면 없어지지만 망막 내층은 거의 영향을 받지 않는다.
NO.4 고양이와 개 모형
고양이 눈은 사람 눈의 황반부 망막 중앙부와 비슷한 구조를 갖고 있다는 연구도 있다. 고양이 약물 용량에 대한 민감성이 영장류(Primate)와 비슷하다는 연구 결과가 나와 영장류 실험 연구에 편의를 제공했다. Abyssinian 고양이는 상염색체 열성유전RP의 동물모델로, 우성유전모델을 갖추고 있다는 학자도 있다. 이 동물모델은 초기에는 간상 세포(rod cell)가 손상됐고 말기에는 간상 세포와 추상 세포(cone cell)가 모두 손상되는 것으로 나타났지만 유전자형은 아직 확인되지 않았다. 개 실험동물 모델은 극히 일부에서 X연관유전인 것을 제외하고는 대부분 상염색체 열성유전이다. 연구자들은 지금까지 수많은 개 RP 모델을 발견해 실험 연구를 위한 계통을 만들었다.
인공 유전자 이식(transgenic) 모델
NO.1 RHO 유전자 녹아웃 마우스
RHO 유전자는 RP 발병과 관련된 유전자로 알려져 있으며, 세계적으로 RHO 유전자 돌연변이에 대한 많은 연구가 보고되고 있으며, 상염색체 우성유전 RP 발병에서의 보고는 더욱 광범위한다. 현재 100여 종의 RHO 유전자 돌연변이가 연이어 발견되었는데, 그 중 과오돌연변이(missense mutation)가 다수를 차지한다.
NO.2 RPE-65 유전자 녹아웃 마우스
RPE-65 코딩된 망막색소 상피 특이성 단백질은 분자량 65000으로 망막색소 상피표면에 광범위하게 발현된다. 이 단백질은 망막색소 상피에서 비타민A의 대사와 관련이 있으며 주로 비타민A의 대사와 RHO의 재생에 관여한다. RPE-65 유전자를 제거하면 생쥐 망막색소 상피세포의 기능장애를 일으켜 all-trans-retinol의 과축적과 11 CIS retinol 의 결핍을 초래한다. RPE-65는 시각회로( visual cycle)에 11 CIS retinol의 이성질화에 중요한 역할을 한다.RPE-65 유전자 녹아웃 마우스는 주로 상염색체 열성 유전이다.
부분 RP 동물 모델 목록
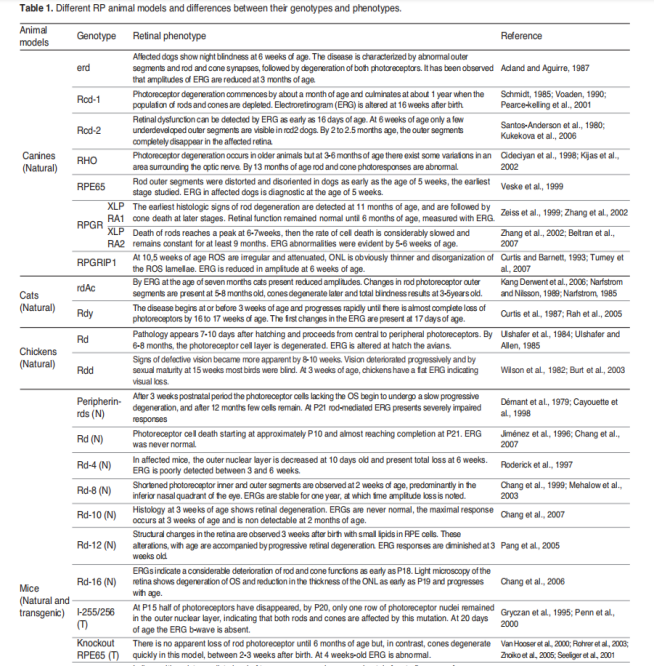
표2 부분RP 동물모델[5]
RDDC는 희귀병 연구에 도움을 준다

Cyagen은' 희귀병 유전자 디코딩 프로그램' 을 시작하며, AI를 통한 희귀질환 진료 호소에 적극 호응해 RDDC 구축을 돕고 희귀질환 병원성 유전자 데이터 보완에 힘쓰고 있다.
사용자가 RDDC에 접속하면 해당 희귀병에 대한 전반적인 정보를 알 수 있을 뿐만 아니라 각종 AI 도구를 이용하여 병원성 예측, 절개 부위(Splice site) 변경 예측 등 희귀병 진료 연구 및 치료 방안 개발에 박차를 가할 수 있다.
자세한 정보는 홈페이지(rddc.tsinghua-gd.org)에서 확인할 수 있다.
*성명: RDDC 데이터와 도구는 과학 연구용으로만 사용되며, 참고용으로만 제공되며, 의학적 진단과 평가의 최종 결론으로 사용할 수 없다.
Cyagen 안과 유전자 치료 솔루션
Cyagen는 안과유전자치료가 장기적으로 직면한 다각적인 어려움을 해결하기 위해 안과유전자치료 플랫폼을 적극적으로 배치하고, 고급 미세화 소동물 안과기기 설비와 베테랑 전문인력을 배치하여 고객에게 전임상 표준화된 안과유전자치료연구 전반의 서비스를 제공하기 위해 노력하고 있다. 더 많은 유전자 치료법이 임상시험에 들어가 선천적으로 실명된 사람들이 하루빨리 빛을 볼 수 있도록 도와주기 바란다. 8620-31601779 또는 [email protected]으로 문의주세요~
참고 문헌 및 인용 사진 출처:
[1] Zhang, Q. . "Retinitis Pigmentosa: Progress and Perspective." Asia Pac J Ophthalmol 5(2016).
[2] 闻思敏, 邵毅, 周琼. "视网膜色素变性发病机制及治疗进展." 眼科新进展 40.3(2020):6.
[3] A, Dyonne T Hartong , P. E. L. B. B , and P. T. P. D. A . "Retinitis pigmentosa." Lancet 368.9549(2006):1795-1809.
[4]Zhang, Q. . "Retinitis Pigmentosa: Progress and Perspective." Asia Pac J Ophthalmol 5(2016).
[5]Agurtzane Rivas, Miren, and Elena Vecino. "Animal models and different therapies for treatment of retinitis pigmentosa." Histology and histopathology (2009).
[6]苑伏香等. "视网膜色素变性的研究进展." 青岛大学学报:医学版 55.6(2019):5.




영업일 기준 1-2일 내에 답변해 드리겠습니다.